
라울의 법칙은 용액에서 용질이 휘발성 용매의 증기압을 낮추는 현상을 설명하는 중요한 법칙입니다.
이 법칙은 화학, 물리학, 공업 분야에서 널리 활용되며, 특히 이상 용액의 거동을 예측하는 데 사용됩니다.
1. 라울의 법칙이란?
라울의 법칙은 프랑스 화학자 프랑수아 마리 라울이 발견한 법칙으로, 용액의 증기압은 순수한 용매의 증기압보다 낮아진다는 개념을 설명합니다.
✅ 라울의 법칙 수식
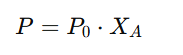
- P: 용액의 증기압
- P₀: 순수한 용매의 증기압
- X_A: 용매의 몰분율 (전체 용액에서 용매가 차지하는 비율)
즉, 비휘발성 용질이 용매에 용해될수록 증기압이 감소하게 됩니다.
2. 라울의 법칙의 주요 특징
✅ 이상 용액에서의 적용
- 용질과 용매 분자 간의 상호작용이 거의 없고, 이상 용액(ideal solution) 상태일 때 가장 정확하게 적용됩니다.
- 이상 용액에서는 용매와 용질의 상호작용이 동일하거나 유사해야 함.
- 이상 용액이 아닌 경우(비이상 용액), 실제 실험 결과는 라울의 법칙과 다르게 나타날 수 있음.
✅ 비휘발성 용질의 효과
- 비휘발성 용질(예: 설탕, 염화나트륨 등)을 용매에 녹이면, 해당 용질은 휘발하지 않으므로 전체 용액의 증기압이 낮아짐.
- 용질의 몰분율이 증가할수록 용매의 몰분율은 감소하여 증기압도 감소.
✅ 휘발성 용질의 효과
- 휘발성 용질(예: 알코올과 물의 혼합물)의 경우, 두 성분 모두 휘발성이므로 각각의 증기압을 합산해야 함.
- 이 경우, 증기압은 개별 성분의 몰분율에 비례하여 계산됨.
3. 라울의 법칙의 응용 분야
✅ 1) 증기압 내림(Vapor Pressure Lowering)
- 비휘발성 용질이 포함된 용액에서는 순수한 용매보다 증기압이 낮아짐.
- 예: 소금물(염화나트륨 + 물) 은 순수한 물보다 증기압이 낮음.
✅ 2) 끓는점 오름(Boiling Point Elevation)
- 증기압이 낮아지면 끓는점이 상승(더 높은 온도에서 끓음).
- 예: 소금물의 끓는점이 순수한 물보다 높음.
✅ 3) 어는점 내림(Freezing Point Depression)
- 용액의 증기압이 낮아지면서 어는점이 감소.
- 예: 겨울철 도로에 염화칼슘을 뿌리면 어는점이 낮아져 얼음이 잘 녹음.
✅ 4) 삼투압(Osmotic Pressure)
- 용질이 포함된 용액은 삼투 현상을 통해 농도가 낮은 용액에서 농도가 높은 용액으로 용매가 이동함.
- 예: 식물의 뿌리가 물을 흡수하는 원리.
4. 라울의 법칙의 한계점
❌ 1) 비이상 용액의 존재
- 현실에서는 대부분의 용액이 이상 용액이 아니므로 오차가 발생할 수 있음.
- 예: 물 + 에탄올 혼합물은 수소 결합으로 인해 라울의 법칙과 다르게 거동함.
❌ 2) 강한 분자 간 상호작용
- 이온성 용질(예: NaCl)은 물과 강한 전기적 인력을 가지므로, 증기압이 예상보다 크게 감소할 수 있음.
5. 결론: 라울의 법칙 요약
✅ 라울의 법칙은 용질이 용매의 증기압을 감소시키는 법칙으로, 이상 용액에서 정확하게 적용됨.
✅ 증기압 내림, 끓는점 오름, 어는점 내림 등 다양한 현상을 설명하는 기초 법칙.
✅ 비이상 용액이나 강한 분자 간 상호작용이 있는 경우 오차가 발생할 수 있음.
라울의 법칙은 화학, 물리, 공업, 생명과학 등 다양한 분야에서 활용되며, 특히 용액의 물리적 특성을 이해하는 데 중요한 역할을 합니다.